Jerome Kluza
Axes de recherche
Dérégulations du métabolisme cellulaire dans les cancers solides et les hémopathies malignes

financé par La Ligue Contre le Cancer (Comité du Nord
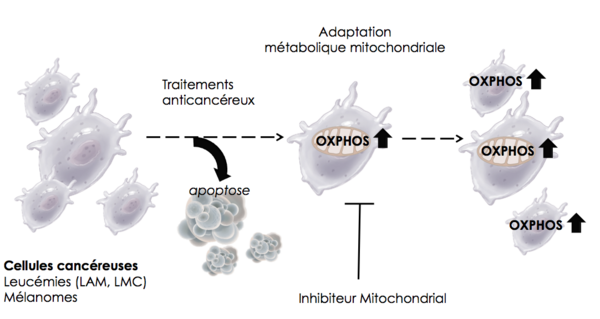
A l’heure actuelle, les thérapies ciblées représentent une approche thérapeutique majeure dans le traitement des cancers. Bien que la plupart de ces médicaments présentent initialement une efficacité importante, ils ne parviennent pas toujours à éliminer toutes les cellules tumorales, limitant l’efficacité des traitements à moyen ou long terme. Ainsi, il est clairement admis que les épisodes de rechute chez les patients atteints de cancer sont liés à la persistance de cellules qui survivent au cours du traitement. En fonction des cancers et traitements prescrits, les caractéristiques phénotypiques de ces cellules « persistantes » peuvent être différentes. Ces cellules regroupent un ensemble hétérogène de cellules pouvant être quiescentes, présentant des caractères de cellules souches et/ou sous diverses formes de dormance tumorale. Plus récemment, il a été montré que ces cellules persistantes, peuvent aussi présenter des caractéristiques métaboliques particulières permettant d’établir de nouvelles stratégies afin de les éradiquer. Ainsi, plusieurs groupes ont montré que certaines cellules tumorales ayant persisté deviennent exclusivement dépendantes de la phosphorylation oxydative mitochondriale pour maintenir un niveau d’ATP nécessaire à leur survie. C’est le cas par exemple des mélanomes BRAFV600E traités par les inhibiteurs de MAP kinase ou des leucémies myéloïdes Bcr-Abl traitées par des inhibiteurs de tyrosine kinase. Cependant, les mécanismes mis en jeu pour soutenir la phosphorylation oxydative mitochondriale des cellules persistantes aux traitements dépendent à la fois du type cellulaire et des traitements auxquels ces cellules ont été exposées. En fonction des modèles, plusieurs mécanismes différents ont été mis en évidence telles qu’une augmentation de la biogénèse mitochondriale dépendante de PGC1a, une augmentation de l’oxydation de certains substrats énergétiques tels que la glutamine ou les acides gras. Il convient donc clairement de définir les mécanismes qui soutiennent spécifiquement le métabolisme mitochondrial dans les cellules persistantes afin de sélectionner la meilleure cible thérapeutique potentielle pour éradiquer ces cellules.
Dérégulation du métabolisme cellulaire dans les pathologies non cancéreuses (Azheimer, Parkinson, Obésité, Inflammation, pathologies broncho-pulmonaires, Immunité)

Mes recherches portent aussi dans le cadre de collaboration sur les dysfonctions du métabolisme cellulaire dans d’autres situations pathologiques comme l’inflammation, les atteintes broncho-pulmoniaire, le diabète et les maladies neurodégénaratives. L’objectif de ces études consistent à évaluer l’impact des modifications de la phosphorylation oxydative mitochondriale ou de la glycolyse dans différents processus physiopathologiques.
Pour toutes informations contacter: William Laine, Technicien de Recherche en charge des études d'oxymétrie avec la Technologie Seahorse (william.laine@univ-lille.fr)
Dans la maladie d'Alzheimer:
Collaboration avec le Dr Valérie Vingtdeux.
iScience. 2018 Nov 30;9:1-13; Methods Mol Biol. 2018;1732:289-305.
Dans les CAR T-cells:
Collaboration avec le Dr Suman Mitra
Dans les cellules dendritiques tolérogènes:
Collaboration avec Pr Nadira Delhem / Dr Olivier Morales
Dans la maladie de Parkinson:
Collaboration avec le Pr David Devos.
Antioxid Redox Signal. 2014 Jul 10;21(2):195-210; Neuroscience. 2011 Jan 13;172:110-7.
Dans les modèles murins exposés aux fumées de cigarettes:
Collaboration avec le Dr Philippe Gosset et Dr Muriel Pichavant.
Respir Res. 2016 Jul 26;17(1):94.
Dans les cellules bronchiques exposées aux polluants:
Collaboration avec le Pr Guillaume Garçon / Dr Jean Marc Lo Guidice:
Métabolisme mitochondriale des cellules bronchiques exposées aux particules PM2.5 et microparticules.
Métabolisme mitochondriale des cellules bronchiques exposées aux fumées de cigarette électroniques.
Environ Pollut. 2018 ; 243(Pt B):1434-144; Environ Int. 2020 Sep;142:105830; J Hazard Mater. 2022 Feb 5;423(Pt B):127246
Dans les cellules cardiaques:
Collaboration avec les Dr Florence Pinet et Dr Emilie Deruy
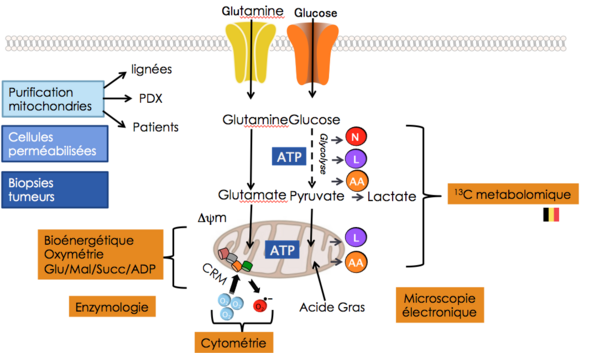
Méthodologies du laboratoire