Olivier Pluquet
Axes de recherche
Rôle du stress du Réticulum Endoplasmique (RE) et de l'UPR dans l'établissement du phénotype sénescent
La sénescence est un état physiologique particulier apparaissant in vitro et in vivo après des cycles de réplication successifs et/ou après exposition à différents types de stress. La sénescence peut être défini comme un état cellulaire caractérisé par un arrêt du cycle cellulaire associé à plusieurs changements incluant des modifications génétiques, épigénétiques, métaboliques, et morphologiques. De plus, les cellules sénescentes montrent un changement caractéristique de leur sécrétome (appelé SASP pour Senescence-Associated Secretory Phenotype).
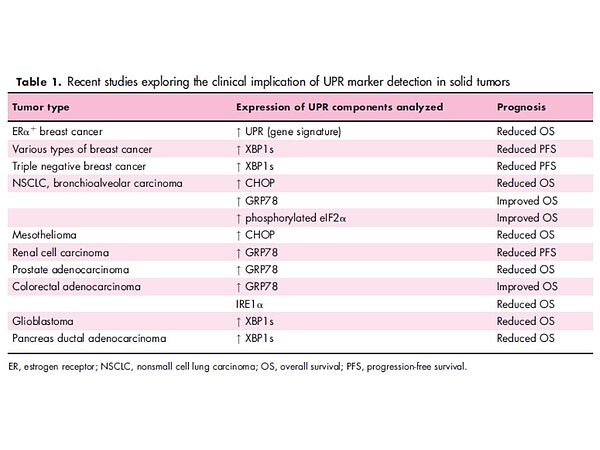
Nous avons démontré dans kératinocytes et les fibroblastes du derme humain qu’un stress du réticulum endoplasmique (RE) (organite majeur de la voie de sécrétion) suivi de l'activation de la réponse UPR (Unfolded Protein Response) est prépondérant dans la mise en place du SASP. La réponse UPR est composée de 3 voies (PERK, IRE1a, ATF6a) conduit à la réduction de la synthèse globale des protéines, ainsi qu’à la transcription de programmes spécifiques régulant l’homéostasie de la cellule, ainsi que la balance survie/mort cellulaire. Durant la sénescence, l’activation de la voie ATF6 (un facteur de transcription), joue un rôle majeur dans l’activité et la masse lysosomale, la forme des cellules, et la dynamique du réticulum endoplasmique (Figure ci-dessous) [1,2]. A partir d’approches transcriptomiques, nous avons déterminé que l’établissement et la maintenance du phénotype sénescent est lié à l’activation de la voie intracrine ATF6/PTGS2/PGE2, mais aussi à l’expression de transporteurs d’acides aminés [3,4]. Nos objectifs sont de déterminer le rôle des effecteurs d’ATF6a qui peuvent influencer l'élargissement cellulaire ainsi que les mécanismes dépendants d'ATF6a qui régissent d'autres processus associés à la sénescence et liés au fonctionnement du réticulum endoplasmique, y compris l'autophagie et le sécrétome associé aux sénescence phénotype (SASP).
[1] Pluquet O et al. (2015) Am J Physiol-Cell Physiol 308:C415-25.
[2] Druelle C et al. (2016) Oncotarget 7:67699-715.
[3] Cormenier J et al. (2018) Mech Ageing Dev 170:82-91.
[4] Bauwens E et al. (2023) J invest Dermatol 143:554-565.e9.
Impact de l'UPR dans l'échappement à la sénescence
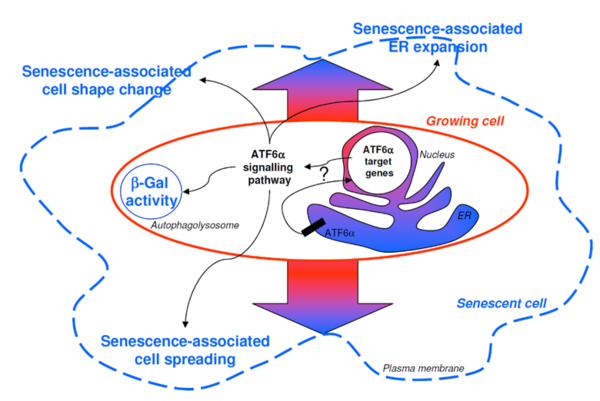
Cet axe se propose d’investiguer le rôle du RE permettant aux cellules tumorales d’échapper à la sénescence. Contrairement au dogme établi dans les fibroblastes, l’arrêt caractéristique dans le cycle cellulaire n’est pas irréversible dans les cellules épithéliales. Environ une cellule épithéliale sénescente sur 10 000 ré-entre en phase S puis effectue une mitose bourgeonnante atypique qui génère des cellules post-sénescentes transformées capables de former des hyperplasies ou des petits carcinomes dans des essais de tumorigenèse chez la souris. Afin de mieux comprendre les bases moléculaires du processus de transformation précoce, nous avons établi par transcriptomique, une signature génétique spécifique des premières étapes de la tumorigenèse [5]. Par ailleurs, nos résultats expérimentaux montrent que les inhibitions par siRNA de PERK, et d'ATF6α dans une moindre mesure, mais pas d'IRE1α, augmentent la fréquence de clones de cellules transformées post-sénescence (Figure ci-dessous, flèche bleu: cellule sénescente, flèche rouge cellule transformées post-sénescente, barre noire représente 100um) ainsi que l'apparition de clones plus larges comparé à la condition témoin. Nous étudions dans les cellules épithéliales, le lien entre UPR et différents processus biologique (incluant stress oxydant, autophagie….) dans l’échappement à la sénescence [6,7,8,9,10]. Nos données pourraient ouvrir de nouvelles voies afin d’explorer des thérapies pouvant diminuer l'incidence des tumeurs associées à l'âge.
[5] Martin N et al. (2014) Mol Cancer 13 :151
[6] Deruy E et al. (2014) Cell Death Dis. 5:e1577
[7] Nassour J et al. (2016) Nat Commun. 7:10399
[8] Drullion C et al. (2018) Cancer Letters. 438:187-196
[9] Pluquet O et al. (2019) Cancer Letters. 463:50-58
[10] Pluquet O and Abbadie C (2021) Adv Cancer Res. 150:285-334
Contrôle de la protéostasie régulée par le Réticulum Endoplasmique dans la progression tumorale
Cet axe s’attache à mieux comprendre le rôle du contrôle de la protéostasie au niveau du réticulum endoplasmique. Nous avons étudié l’impact de l’UPR dans l’altération de la protéostasie des cellules cancéreuses du foie dans des contextes de ciblage thérapeutique [11,12]. A présent, nous focalisons nos efforts sur l'impact des signatures de l'UPR dans un contexte clinique de cancers de la jonction oeso-gastrique.
[11] Galmiche et al. (2016) Trends Cancer. 2:219-221
[12] Galmiche et al. (2017) Curr Opin Oncol. 29:41-47